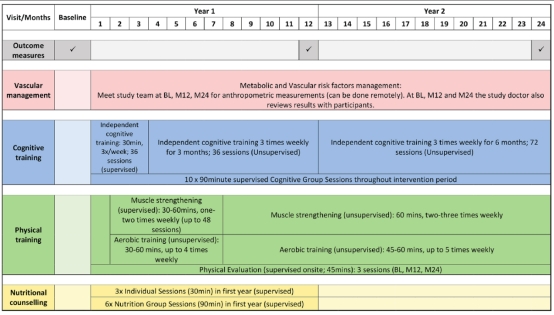
2021年2月5日,我院徐欣课题组在阿尔茨海默病与痴呆杂志上在线发表题为 “SINgapore GERiatric intervention study to reduce physical frailty and cognitive decline (SINGER)–pilot: A feasibility study” 的研究论文。该论文探究了多领域生活方式干预对社区老年人躯体衰弱及认知功能的影响,并讨论了该干预方式在亚洲国家初级卫生保健系统下大范围推广的接受度及可行性,研究结果为痴呆防治与干预提供了新思路。徐欣研究员为本文共同第一作者及独立通讯作者。痴呆不仅给患者个人及其家庭,乃至社会都带来沉重的负担。由于痴呆存在异质性和复杂性,聚焦单一维度的干预效果不显著,其长期有效性仍不明确,因此,针对多项危险因素的多领域生活方式干预为痴呆的预防提供了希望。徐欣研究员作为全球多领域生活方式干预-WW-FINGERS(World Wide FINGERS, WW-Fingers)战略合作网络的联盟成员,在新加坡开展了相关的干预研究(SINGER),旨在探索多领域生活方式干预在亚洲国家实施的本土化调整。 在本论文中,徐欣课题组对新加坡社区老年人开展了为期2年的随机对照临床试验,对干预组和对照组分别实施亚洲本土化多领域生活方式干预(SINGER)与已在欧洲人群中得到验证的干预模式(FINGER),干预内容主要包括认知干预、营养指导、体育锻炼、血管和代谢危险因素管理四个维度。研究结果显示试验中干预完成度为80%,且两种干预均能显著提高受试者躯体功能水平,除此之外,SINGER组受试者在血压控制方面表现更佳。该研究展现了多领域生活方式干预在痴呆预防中的积极作用,且该干预模式的本土化调整在亚洲社区老年人中有广阔的应用前景。 该工作得到了Miia Kivipelto博士, Tiia Ngandu博士,Alina Solomon博士和FINGER 团队的帮助。 原文链接:https://alz-journals.onlinelibrary.wiley.com/doi/10.1002/trc2.12141 图1.亚洲本土化多领域生活方式干预(SINGER)的干预内容及时间轴
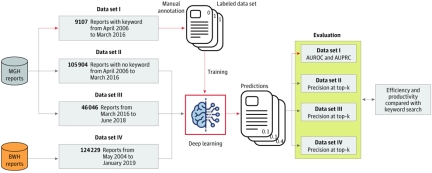
2020年11月16日,我院杨杰研究员在JAMA Network Open杂志上在线发表题为“Development and Validation of a Deep Learning Model for Detection of Allergic Reactions Using Safety Event Reports Across Hospitals”的研究论文。该论文利用最先进的深度学习技术从哈佛医学院附属Massachusetts General Hospital 以及Brigham and Women’s Hospital,两家医院近30万份事故报告中自动寻找过敏事件,以改善医院就诊环境。杨杰研究员是本文的第一作者兼通讯作者。本研究利用基于注意力的深度学习技术,对医院事故报告进行深度编码,并且最终构建分类器进行过敏事件预测,其AUROC可以达到0.979(95% CI, 0.9730-0.985),AUPRC可以达到0.809(95% CI, 0.773-0.845)。本研究在多种环境下对深度学习模型进行了外部评估,包括不同时间段的性能评估,跨医院的性能评估,实验结果证明模型的在不同环境下均能取得不错的效果,泛化性能好。利用注意力机制也给模型带来了一定的可解释性,本文的深度学习技术在大数据中自动发现多项先前被专家遗漏的过敏事件线索,为专家的临床知识补充提供了较好的数据支撑。 原文链接:https://jamanetwork.com/journals/jamanetworkopen/fullarticle/2772992 图1. 实验数据与整体设计 图2. 注意力模型提供部分可解释性示例(背景颜色越深即深度学习模型认为约重要的词)
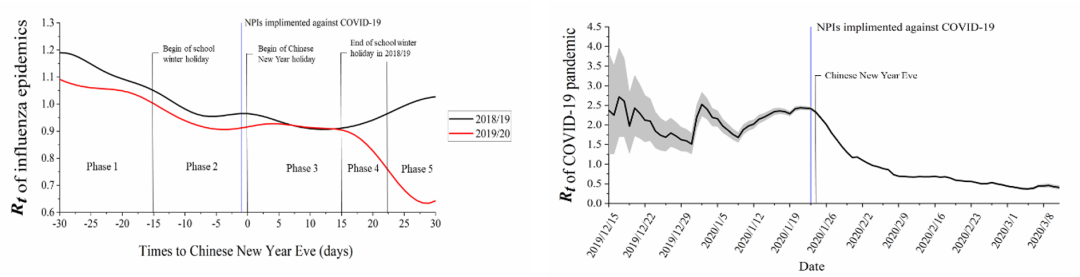
2020年10月20日,浙江大学公共卫生学院雷浩讲师以第一作者在美国传染病学会的旗舰期刊Clinical Infectious Diseases在线发表研究论文“Different transmission dynamics of COVID-19 and influenza suggest the relative efficiency of isolation/quarantine and social distancing against COVID-19 in China”。 该文章获得了中山大学公共卫生学院(深圳)舒跃龙教授、香港大学工程学院李玉国教授、香港大学公共卫生学院Benjamin J Cowling教授的支持。考虑到流感和COVID-19都是呼吸道传染病并且具有相同的传播路径,因此该研究创新性地通过对比疫情期间流感和COVID-19的传播动力学特征,证明在中国如果单独采取隔离/检验检疫或者社交距离防控措施只能使得COVID-19的有效再生数分别降低48.1%和34.6%。由于COVID-19的基本再生数大于2,因此单独采取隔离/检验检疫或者社交距离防控措施都不能使COVID-19的基本再生数降低到小于1的水平,证明了在中国采取的隔离/检验检疫措施与社交距离防控相结合的综合措施是对于阻断新冠疫情的传播是至关重要的。同时雷浩讲师以第一作者在Journal of Infectious Diseases上发表题为“Nonpharmaceutical interventions used to control COVID-19 reduced seasonal influenza transmission in China”的文章发现,非药物干预措施使得中国季节性流感的患病率相较于往年同期下降了64%。耶鲁大学公共卫生学院James L. Hadler教授在杂志同期发表题为“Will SARS-CoV-2 prevention efforts affect the coming influenza season in the United States and northern hemisphere?”的文章,认为来自中国的研究结果特别重要,表明新冠的防控策略同样可以防控流感的传播。原文链接:https://academic.oup.com/cid/article/73/11/e4305/5932276?login=true

衰老生物标志物研究对基础和转化医学均具有重大意义和价值。近年来基于年龄与DNA甲基化(一种重要的表观遗传修饰)之间的密切联系,学者们建立了可以表征衰老的DNA甲基化时钟(表观遗传钟),后者成为目前衰老最具前景的生物标志物。截至目前,已有超过10个DNA甲基化时钟被报道。尽管它们具有共同的理论依据(捕捉衰老信号),但它们与健康结局以及它们彼此之间的关联强度差异较大。此外,学界对它们所表征的潜在生物衰老过程也缺乏了解。近日,浙江大学公共卫生学院与耶鲁大学医学院的研究人员联合在老年医学领域国际顶级期刊《Aging Cell》(IF=9.3,中科院分区,生物1区)在线发表了题为“Underlying features of epigenetic aging clocks in vivo and in vitro”(表征衰老的DNA甲基化时钟在体内外的潜在特征)的最新研究成果。该研究首次全面比较了11个现有的DNA甲基化时钟,并在此基础上开发出一个更可靠且有效的新型DNA甲基化时钟“meta-clock”,具备比现有DNA甲基化时钟更强的全因死亡预测效力,并且更能区分肿瘤和正常组织,反映衰老特征,具有巨大的应用前景。 在这项研究中,研究人员首先对目前已报道的11个DNA甲基化时钟所包含的CpG特征进行了详细比较,发现了它们之间较大的差异。随后,研究人员基于CD14+单核细胞和前额叶背外侧皮层(DLPFC)转录组数据,发现Horvath1、Horvath2、Hannum、Levine和Lin 这5个DNA甲基化时钟具有类似的转录组信号。进一步的网络分析鉴别出16个在CD14+单核细胞和DLPFC中的共表达基因模块(consensus expression module),而其中与DNA甲基化时钟密切相关的模块所涉及到的生物过程包括线粒体翻译、免疫、组蛋白修饰、自噬等。紧接着,研究人员发现在单核细胞中具有保守转录组信号的6个DNA甲基化时钟(Horvath1、Horvath2、Hannum、Levine、Lin和Yang时钟)能在一定程度上区分肿瘤组织(例如乳腺癌、结肠癌、肺癌和胰腺癌)与正常组织,其中Levine和Yang时钟效果最为显著。来自体外实验的数据提示,这6个DNA甲基化时钟中的某几个如Levine时钟与细胞衰老和线粒体耗竭这两个重要的衰老机制密切相关,后者进一步证实了前面的转录组分析结果。基于以上结果,研究人员提出假设:表观遗传衰老可能具有多重信号/机制,不同的DNA甲基化时钟可能在不同程度上反映了部分表观遗传衰老信号,通过识别重合信号或许能够构建出更加精确和有效的衰老生物标志物。为了验证这些猜想,作者使用来自全血、DLPFC、表皮/真皮和乳腺组织数据,对现有的DNA甲基化时钟所包含的CpG位点进行共甲基化模块聚类分析,通过数学模型,重新开发出一个新型DNA甲基化时钟——meta clock。进一步分析发现,相比现有的任一种DNA甲基化时钟,meta-clock具有更强的全因死亡预测效力,更能区分肿瘤和正常组织,且更能反映细胞衰老和线粒体耗竭;此外,meta-clock与阿尔茨海默病的病理学指标——神经纤维缠结合和缠结负荷密切相关。 在文章的最后,研究人员写到:“这些发现是揭开DNA甲基化时钟的生物学基础的第一步,将有助于开发更加可靠和有效的衰老生物标志物,以用于临床和转化医学研究。更重要的是,揭示其生物学基础是发现衰老驱动因素并制定针对性干预措施的必要关键步骤”。本研究唯一第一作者为Zuyun Liu (刘足云),系浙江大学公共卫生学院研究员;唯一通讯作者为Morgan E Levine,系耶鲁大学医学院助理教授。本研究得到浙江大学医学院百人计划和美国国立卫生研究院衰老研究所相关经费支持。全文链接:https://onlinelibrary.wiley.com/doi/10.1111/acel.13229
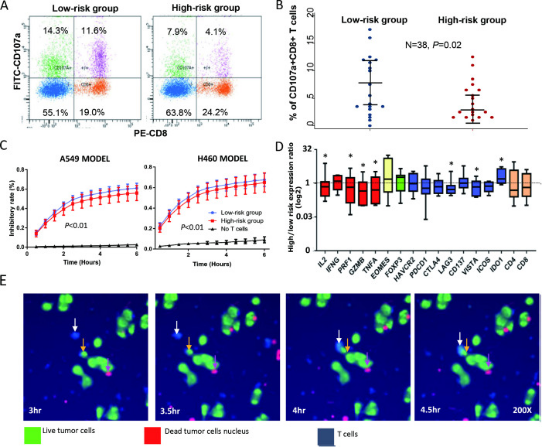
吴息凤教授在《Journal for ImmunoTherapy of Cancer》上发表题为“Genetic associations of T cell cancer immune response-related genes with T cell phenotypes and clinical outcomes of early-stage lung cancer”的研究。该研究于2020年8月发表,研究揭示了T细胞癌免疫应答相关基因与早期肺癌T细胞表型和临床结局的遗传相关性。T细胞相关免疫治疗的最新进展显著促进了非小细胞肺癌(NSCLC)的治疗。然而,T细胞癌免疫应答基因的遗传变异是否以及如何影响非小细胞肺癌患者的临床结局仍不清楚。为此,本研究评估了941例早期NSCLC患者(发现集n=536;验证集n=405)中280个T细胞癌免疫应答相关基因的2450个单核苷酸多态性(SNPs),以分析其与预后的关联,并观察其对T细胞表型的影响。研究发现,在发现集和验证集中位于10个基因的14个SNP与NSCLC的预后显著相关(p<0.05)。其中,TRB:rs1964986是荟萃分析后与复发风险最相关的变异(HR 1.84,95%CI 1.35 - 2.52,p=1.15E-04),而IDO1:rs10108662是与死亡风险最相关的SNP(HR 1.87,95%CI 1.40 - 2.51,p=2.17E-05)。多个不良基因型对死亡和复发风险具有累积影响。在单纯手术组和手术加化疗亚组中,七种治疗特异性变体在两个亚组中与预后的关联方向相反。表达量性状基因座分析表明,6个SNP与其相应的基因表达显著相关。用SNP定义的高危患者的T细胞脱颗粒减少(p=0.02),对癌细胞的细胞毒性降低(p<0.01)。基因表达谱显示高危受试者IDO1表达增加,IL2、PRF和GZMB表达降低。本研究揭示T细胞癌免疫应答途径的基因变异可影响预后,并可作为早期NSCLC患者治疗效果的预测因子。免疫基因型与T细胞抗肿瘤免疫之间的相关性表明宿主免疫遗传学与NSCLC预后之间存在生物学联系。 图1. 不利基因型(UFGs)在体外T细胞癌免疫应答和T细胞脱颗粒中的作用
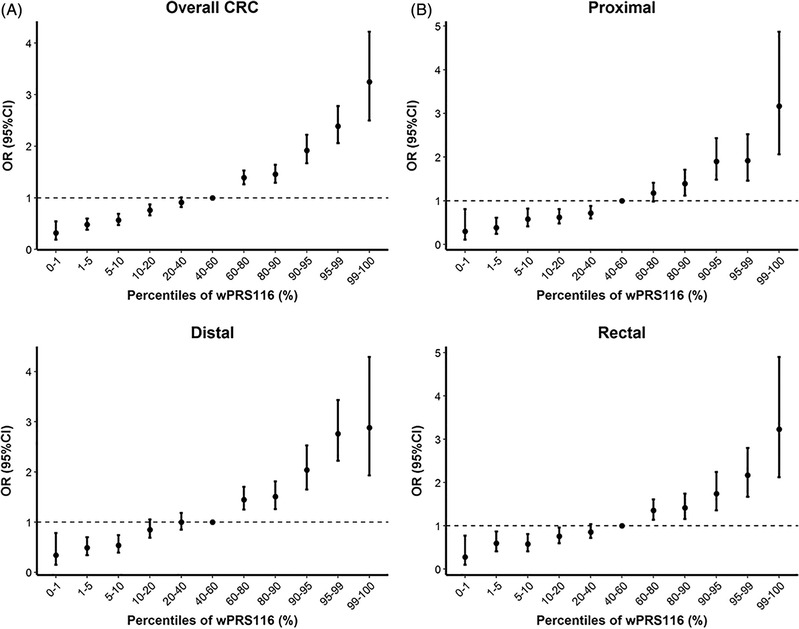
越来越多的研究确定了与结直肠癌相关的常见遗传变异,且基于常见遗传变异建立的多基因风险评分(PRS)可针对性的识别高风险人群。为了全面优化、测试遗传风险评分以预测结直肠癌的发生风险,我们的研究通过结合结直肠癌的遗传变异和潜在的结直肠癌风险因素及相关复杂性状建立风险分层预测模型,评估该遗传风险评分在一般人群中的分层效能。本研究利用11项全基因组关联研究(GWASs)的荟萃分析结果(16871例结直肠癌病例和26328例对照),鉴定出了1,593个与结直肠癌显著相关的遗传变异位点(P<5×10−8)。将苏格兰结直肠癌病例对照研究(6,478例结直肠癌病例和11,043例对照)作为测试集,建立具有多个候选多基因风险评分的遗传预测模型;英国生物样本库(4800例结直肠癌病例和20287例对照)作为验证集,以评估该模型的最佳预测效能。图1 UKBB中wPRS116的百分位数与位点特异性CRC风险之间的风险比和置信区间结果显示,基于116个遗传变异位点建立的加权多基因风险评分(wPRS)具有最佳预测效能,该评分在苏格兰测试集中报告的C-统计量为0.60,且与结直肠癌风险显著相关(OR = 1.46,95%CI: 1.41-1.50,P = 1.71 × 10−116)。此wPRS的预测效能在英国生物样本库验证集中得到一致结果,C-统计量为0.61,并与结直肠癌风险呈显著相关性(OR=1.49,95% CI = 1.44-1.54,P = 6.67 × 10−128)。目前,遗传风险评分(PRS)作为一种个性化的遗传评估,可以在任意年龄段检测,不易受时间、环境、生活行为习惯等因素干扰,已成为人群风险筛查的一种重要手段。在这项研究中,我们将遗传风险评分的预测效能与结直肠癌的多个区域遗传评分进行比较,表明遗传风险评分具有更广泛的应用潜力,这将为个体化精准筛查提供指导性建议。原文链接:https://onlinelibrary.wiley.com/doi/10.1002/ijc.33191
近日,国际权威学术期刊《血液学》(Blood,影响因子16.6)在线发表了浙江大学医学院王福俤教授、闵军霞教授和郑树森院士团队合作研究新成果。论文题目为 “Hepatic Transferrin Plays a Role in Systemic Iron Homeostasis and Liver Ferroptosis”【1】(图1)。该成果系统揭示并阐明肝脏转铁蛋白(Transferrin, Trf)通过调控铁死亡抑制肝脏损伤、纤维化及肝硬化发生的功能及致病分子机制。该研究通过在国际上率先构建的肝实质细胞特异敲除转铁蛋白基因的小鼠模型,展现出机体组织铁蓄积、铁死亡及肝纤维化的系列典型病理特征;并进一步功能筛选发现金属膜蛋白Slc39a14(Zip14)是转铁蛋白缺失引发的组织器官铁蓄积的关键转运蛋白;阐明敲除Slc39a14能够完全逆转非转铁蛋白结合铁(NTBI)蓄积以及肝细胞铁过载导致的肝细胞铁死亡和肝纤维化。该重大研究成果不仅为防治肝损伤、肝纤维化及肝硬化等疾病提供了新靶点(转铁蛋白及Slc39a14),而且为进一步深入研究肝纤维化及肝硬化的致病机制提供了新思路。图1. Online发表论文首页肝脏纤维化是多种致病原因所致的慢性肝脏损伤后发生的肝内结缔组织异常增生性疾病,长期发展会导致肝硬化,是一种世界范围内较为常见的致死病因。目前,除肝脏移植外,针对肝纤维化及肝硬化尚缺乏有效治疗措施【2】。因此,早期发现及预防肝损伤、肝纤维化及肝硬化的发生对于改善肝脏疾病的转归及预后至关重要。长期以来,人们早就观察到肝脏组织中铁过载与肝功能障碍密切相关,但铁过载是否直接引发肝脏损伤及其发生机制尚不明确。比如早在19世纪,人们认识到以铁过载为主要病理特征的血色病(Hemochromatosis)。遗传性血色病是一种常染色体隐性遗传病,在欧美人群中发病率较高(约为1/200)。已知其发生主要由于铁代谢调控基因(HFE, HJV, HAMP, TFR2, FPN)突变所导致的铁的过量摄取和组织内铁蓄积,患者晚期多发展为肝硬化、肝癌、糖尿病和心血管疾病等,严重危害人类健康【3】。王福俤/闵军霞教授团队2017年在肝脏研究领域国际著名期刊《肝病学》(Hepatology)发表了题为“Characterization of Ferroptosis in Murine Models of Hemochromatosis”的封面论文(图2),该研究成果在全球首次利用多种铁过载性基因敲除小鼠模型发现并阐明铁死亡是铁过载诱发肝脏损伤中的重要致病机制【4】。该成果在小鼠体内首次揭示胱氨酸转运蛋白Slc7a11通过调控铁死亡参与铁过载小鼠肝损伤的发病机制而备受国际学术界重视。图2. 王福俤团队2017年《Hepatology》封面研究近期,王福俤/闵军霞/郑树森院士团队合作在铁死亡调控肝损伤领域的深入探索过程中发现转铁蛋白缺失是导致铁死亡引发肝损伤、肝纤维化及肝硬化的主要病理机制。转铁蛋白是血液循环中的含铁蛋白之一,主要由肝脏分泌,通过结合并将血液循环中的铁离子转运到机体的各组织器官中利用。血液循环中的铁离子有多种存在方式,其中转铁蛋白结合铁(Transferrin Bound Iron, TBI)是最主要的存在方式,其余少量不与Transferrin 结合,统称为非转铁蛋白结合铁(Non-Transferrin Bound Iron, NTBI),NTBI增多会诱导氧化自由基产生并导致细胞毒性。为了研究转铁蛋白在肝脏组织中的功能,研究者首先利用Cre/loxP技术构建了编码转铁蛋白(Transferrin, Trf)基因的肝实质细胞特异性敲除小鼠(Trf-LKO)。研究发现肝实质细胞特异敲除Trf后,小鼠铁调素Hepcidin表达水平下降,全身铁代谢发生明显紊乱;小鼠主要表现为造血异常、血清中NTBI水平急剧升高同时伴随肝脏中铁离子蓄积,并在6-12月龄时观察到肝脏脂质过氧化损伤。进一步在高铁饲喂以及慢性四氯化碳注射的两种常用肝纤维化动物模型中,研究者们发现肝实质细胞特异性敲除Trf小鼠出现严重肝纤维化的表现,并伴随肝脏脂质过氧化损伤增强、铁死亡调控基因表达异常。这些数据提示铁死亡在低转铁蛋白相关的肝纤维化发生中可能发挥作用。图3: 肝脏Trf敲除小鼠发生肝纤维化(选自论文,Figure 2)进一步探索机制过程中,研究人员给上述疾病模型小鼠腹腔注射铁死亡抑制剂Ferrostatin-1(Fer-1),发现Fer-1治疗组小鼠的肝纤维化表型明显缓解,表明细胞铁死亡是低转铁蛋白相关的肝纤维化发生的关键致病机制。图4.铁死亡抑制剂有效逆转肝脏纤维化(选自论文,Figure 3)接下来的关键科学问题是:在肝脏缺乏转铁蛋白时,为什么NTBI会进入肝脏并在肝脏蓄积?通过对Trf-LKO小鼠金属转运蛋白的筛选,研究人员锁定金属离子转运蛋白Slc39a14。有趣的是,王福俤团队前期曾报道该蛋白在生理条件下主要转运锰离子【6】。为明确这一关键问题,研究团队在国际上首次成功制备了肝实质细胞特异性敲除Trf和Slc39a14的双基因敲除小鼠模型(DKO),并且惊喜地发现,抑制Slc39a14的表达能明显改善肝脏NTBI的蓄积,并显著减轻脂质过氧化及铁死亡引发的肝损伤,从而成功逆转了肝实质细胞Trf敲除小鼠的铁死亡及其诱发的肝纤维化。这些结果不仅进一步明确了NTBI蓄积是诱发肝脏铁死亡的分子机制,同时提示Slc39a14有望成为治疗低转铁蛋白及铁死亡相关肝脏疾病的重要靶点。图5.肝实质细胞特异敲除Slc39a14逆转Trf缺失导致的肝脏纤维化(选自论文,Figure 4)小鼠的这些系列发现是否与临床相关疾病有关?为了进一步探究临床患者转铁蛋白与肝纤维化关联特征,研究人员通过分析肝硬化患者和正常健康对照的血清学指标,发现肝硬化患者的血清转铁蛋白水平显著低于健康对照人群;并且肝硬化患者的肝纤维化四项与血清转铁蛋白水平之前存在显著负相关。这些临床相关分析进一步提示转铁蛋白缺乏在肝纤维化/肝硬化的发生发展中可能扮演重要角色。此外,基于肝硬化患者的肝穿样本的检测结果,发现肝硬化患者的肝脏转铁蛋白水平明显减少,而肝脏铁水平及SLC39A14蛋白表达水平明显增高,进一步表明转铁蛋白缺乏的肝纤维化/肝硬化患者可能通过SLC39A14吸收NTBI,随后激发了脂质过氧化性肝损伤、肝纤维化及肝硬化。这些数据提示抑制铁死亡或SLC39A14有望成为潜在的防治肝硬化的治疗方式。图6. 肝硬化患者转铁蛋白缺乏及脂质过氧化损伤(选自论文,Figure 7)总之,该重大成果的主要突出贡献为:(1)首次成功制备转铁蛋白组织特异性敲除小鼠模型,为研究转铁蛋白的组织来源及功能提供新型动物模型;(2)阐明了肝脏转铁蛋白缺乏通过铁死亡促发肝纤维化的分子机制;(3)首次明确SLC39A14是组织器官铁离子过载的转运蛋白,解析了困扰科学界半个多世纪的难题;(4)阐明补充转铁蛋白以及抑制铁死亡或SLC39A14能够有效预防及缓解肝纤维化发生发展,为肝纤维化及肝硬化的防治提供了重要新靶点。该成果不仅丰富和阐明肝脏疾病铁死亡发生的分子调控机制,同时为肝脏疾病诊治提供了新靶点和新策略。图7.论文模式图(选自论文online可视模式图)王福俤团队博士研究生余盈盈和蒋丽为共同第一作者;浙江大学医学院王福俤教授、闵军霞教授和郑树森院士为共同通讯作者。浙江大学附属第一医院沈哲医师及美国哈佛大学医学院/麻州总医院Raymond T. Chung教授和Tuo Shao博士后参与了部分工作。浙江大学附属第一医院虞朝辉教授及陈保德副主任技师为临床对接提供了帮助。该研究成果得到国家重点研发计划、国家自然科学基金以及中国博士后科学基金的经费资助。图8.论文第一作者及通讯作者(从右:余盈盈、王福俤、闵军霞、蒋丽)Blood杂志论文链接:https://ashpublications.org/blood/article/doi/10.1182/blood.2019002907/454783/Hepatic-Transferrin-Plays-a-Role-in-Systemic-Iron参考文献【1】Yingying Yu#, Li Jiang#, Hao Wang, Zhe Shen, Qi Cheng, Pan Zhang, Jiaming Wang, Qian Wu, Xuexian Fang, Lingyan Duan, Shufen Wang, Kai Wang , Peng An, Tuo Shao, Raymond T Chung, Shusen Zheng*, Junxia Min*, Fudi Wang*(王福俤).Hepatic Transferrin Plays a Role in Systemic Iron Homeostasis and Liver Ferroptosis. Blood. doi: 10.1182/blood.2019002907. Online ahead of print.【2】Vilar-Gomez E, Calzadilla-Bertot L, Wai-Sun Wong V, Castellanos M, Aller-de la Fuente R, Metwally M, Eslam M, Gonzalez-Fabian L, Alvarez-Quinones Sanz M, Conde-Martin AF et al: Fibrosis Severity as a Determinant of Cause-Specific Mortality in Patients with Advanced Nonalcoholic Fatty Liver Disease: A Multi-National Cohort Study. Gastroenterology 2018, 155(2):443-457.e417.【3】Pietrangelo A: Hereditary hemochromatosis--a new look at an old disease. The New England Journal of Medicine 2004, 350(23):2383-2397.【4】 Hao Wang, Peng An , Enjun Xie, Qian Wu , Xuexian Fang , Hong Gao, Zhuzhen Zhang, Yuzhu Li, Xudong Wang, Jiaying Zhang , Guoli Li, Lei Yang, Wei Liu, Junxia Min*, Fudi Wang*(王福俤). Characterization of ferroptosis in murine models of hemochromatosis. Hepatology 2017; 66:449-465.【5】Nermi L. Parrow, Yihang Li, Maria Feola, Amaliris Guerra, Carla Casu, Princy Prasad, Luke Mammen, Faris Ali, Edvinas Vaicikauskas, Stefano Rivella, Yelena Z. Ginzburg, Robert E. Fleming. Lobe specificity of iron binding to transferrin modulates murine erythropoiesis and iron homeostasis. Blood. 2019; 134171373–1384 doi: https://doi.org/10.1182/blood.2018893099【6】Yongjuan Xin#, Hong Gao#, Jia Wang#, Yuzhen Qiang, Mustapha Umar Imam, Yang Li, Jianyao Wang, Ruochen Zhang, Huizhen Zhang, Yingying Yu, Hao Wang, Haiyang Luo, Changhe Shi, Yuming Xu, Shintaro Hojyo , Toshiyuki Fukada, Junxia Min, Fudi Wang*(王福俤). Manganese transporter Slc39a14 deficiency revealed its key role in maintaining manganese homeostasis in mice. Cell Discovery 2017; 3:17025.
近日,心血管领域国际著名学术期刊《Circulation Research》(影响因子:15.862)在线发表了浙江大学医学院王福俤/闵军霞教授团队题为“Loss of cardiac Ferritin H facilitates cardiomyopathy via Slc7a11-mediated ferroptosis”的研究论文【1】。该成果系统阐明了铁蛋白(Ferritin)通过调控铁死亡抑制心肌病发生的效应及分子调控机制;首次体内揭示膜蛋白Slc7a11能够通过阻断心肌细胞发生铁死亡而有效逆转铁蛋白缺失导致的心肌病,有望成为心脏疾病防治新靶点。此外,该研究在国际上率先构建了多个心脏铁死亡的遗传小鼠模型(Ferritin H cKO),为靶向心肌细胞铁死亡提供了新模型。该成果不仅阐明了心肌细胞“死”(铁死亡)的新机制,还颠覆性地发现挽救(生)心肌损伤/死亡的新策略——激活心肌细胞SLC7A11,即起‘死’回生。图1. Circulation Research 论文online首页铁死亡是鲜为人知的心脏新杀手心脏疾病是人类健康的头号杀手,其分子机制与转化研究业已成为迫在眉睫的重大公共卫生及医学课题。心肌细胞作为一种典型的非分裂细胞,一旦发生损伤则成为永久性缺失的细胞(永久性细胞),其死亡是心脏损伤与疾病的共同致病基础。因此,探究心肌细胞死亡的调控机制具有重大的研究价值与临床转化意义。一直以来,抑制心肌细胞死亡是保护心脏功能、防治心脏疾病的关键策略。2019年初,王福俤教授课题组在《PNAS》发表了题为“Ferroptosis as a target for protection against cardiomyopathy”的研究论文,该研究成果在全球范围内首次阐明了新型细胞死亡方式—铁死亡(Ferroptosis)在心脏疾病发生发展中的重要作用【2】。论文发表后,国际铁死亡研究权威、德国亥姆霍兹研究中心Marcus Conrad教授在《Cell Research》发表了题为“Broken hearts: Iron overload, ferroptosis and cardiomyopathy”的“研究亮点”(Research Highlight)文章,高度评价了这一重要成果【3】。此外,心血管研究领域顶级期刊《Circulation》以“New Target to Protect Against Cardiomyopathy”为题高度评价了该成果对领域的重要贡献【4】。截止目前,该论文被引用66次,被ESI评选为年度“高被引论文”(Highly Cited Paper)和“热点论文”(Hot Paper)。图2. 王福俤团队2019年PNAS论文与评价转铁蛋白基因敲除加速心脏铁死亡多年来,王福俤团队在心肌细胞铁死亡领域的深入探索过程中,利用Cre/LoxP技术构建了编码铁蛋白重链(Ferritin H, Fth)基因的心肌细胞特异性敲除小鼠(FthMCK/MCK和FthMyh6/Myh6)。铁蛋白由重链(Fth)和轻链(Ftl)两种亚基构成球壳空腔结构,是细胞内最主要的储铁蛋白。胞质中未被利用或排出细胞的铁离子被储存在铁蛋白中,从而维持细胞内铁稳态,减少Fenton反应导致的氧化应激,达到保护细胞的目的。心肌细胞特异性敲除Fth后,小鼠心脏铁代谢发生明显紊乱,并在6月龄时表现出轻度心脏损伤。为了进一步明确Fth在心肌细胞铁稳态中的功能,研究者们给小鼠增加了一定的铁负荷压力,即高铁饲料(High-iron diet,HID)喂养小鼠4周后,心肌细胞特异性Fth敲除小鼠出现心肌肥大并伴有严重的心肌损伤,呈现典型肥厚型心肌病表现。图3. Fth条件性敲除小鼠展现心肌病表型(选自论文,Figure 3)为了探索分子调控机制,研究人员收集心脏样本并进行转录组测序(RNA-seq)筛选;发现“铁死亡”及其密切相关的“谷胱甘肽代谢”通路在Fth敲除的心肌组织中显著上调。进一步研究提示:心肌细胞膜上胱氨酸/谷氨酸反向转运体的功能亚基Slc7a11下调而导致的胞内胱氨酸和还原型谷胱甘肽(GSH)缺乏是诱发心肌细胞发生铁死亡的主要机制。图4.转录组分析发现铁死亡和谷胱甘肽代谢通路(选自论文,Figure 4)铁死亡是否是HID导致心肌细胞Fth敲除小鼠的心脏结构和功能发生异常的关键机制呢?为了回答这一关键科学问题,研究者们运用铁死亡特异性抑制剂Ferrostatin-1(Fer-1)在HID饲喂的同时隔天给予小鼠腹腔注射,结果发现Fer-1处理组小鼠的心脏肥大显著减轻,心脏功能障碍也得到明显缓解,表明铁死亡的确是心脏损伤的罪魁祸首。图5. 铁死亡抑制剂有效逆转心脏损伤(选自论文,Figure 6)过表达胱氨酸转运蛋白SLC7A11逆转心脏铁死亡Slc7a11的下调是诱发Fth敲除小鼠心脏铁死亡的关键,那么Slc7a11过表达是否对铁死亡及其引发的心脏损伤有影响呢?研究团队在国际上首次成功制备了心肌细胞特异性Slc7a11过表达小鼠,通过与心肌细胞特异性Fth敲除小鼠进行杂交后成功获得Slc7a11过表达的Fth缺失小鼠。研究人员惊喜地发现:Slc7a11过表达通过增加细胞内的胱氨酸促进GSH合成,从而成功逆转了Fth心肌细胞敲除小鼠的铁死亡及其诱发的心衰表型。这些结果既明确了GSH缺乏是诱发Fth敲除小鼠发生心脏铁死亡这一分子机制,同时提示Slc7a11有望成为治疗铁死亡相关心脏疾病的重要靶点。图6. 心肌细胞特异性过表达Slc7a11逆转Fth缺失导致的心脏损伤(选自论文,Figure 7)总之,该成果首次揭示Fth心脏特异性敲除小鼠的心力衰竭和心脏损伤的表型主要是通过心肌细胞铁死亡发生的新机制;提供了多个可靠的新型心脏铁死亡小鼠模型,不仅为阐明心脏铁死亡发生的分子调控机制提供理论依据,同时为铁死亡相关心脏疾病的防治提供了新靶点和新策略。图7. 心肌细胞铁死亡模式图(选自论文)王福俤团队博士后方学贤为论文第一作者;浙江大学王福俤教授、闵军霞教授为共同通讯作者。此项研究得到了德国德累斯顿工业大学Andreas Linkermann教授、中国医学科学院陈厚早研究员、浙江大学转化医学研究院陈静海教授的大力帮助;项目受到国家重点研发计划、国家自然科学基金以及中国博士后科学基金的经费资助。图8. 论文通讯作者及第一作者右起:方学贤博士(第一作者),王福俤教授(中)以及闵军霞教授铁死亡是王福俤和闵军霞教授团队重点协同攻关的主要研究方向。通过多年来的不懈努力,团队取得系列相关研究成果。2017年在《Hepatology》杂志发表封面论文,首次报道铁死亡是铁过载导致肝脏病理损伤的重要机制并首次揭示了转运蛋白SLC7A11体内参与调控肝脏细胞铁死亡的过程【5】;之后在《PNAS》刊文首次揭示了阿霉素引发心肌病与心肌缺血再灌注损伤的两种重要体内模型中存在铁死亡及其重要意义,并阐明线粒体膜的脂质过氧化是心肌细胞发生铁死亡的关键机制【2】;团队应邀在《科学通报》发表题为“铁过载及铁死亡在心脏疾病中的研究进展”的封面评述,化用上古神话“女娲补天”形象展示靶向铁死亡防控心脏疾病的转化研究及潜在临床应用的积极前景【6】。《Hepatology》封面(左)《科学通报》封面(右)原文链接:www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.120.316509参考文献【1】Xuexian Fang , Zhaoxian Cai, Hao Wang, Dan Han, Qi Cheng, Pan Zhang, Feng Gao, Yingying Yu, Zijun Song, Qian Wu, Peng An, Sicong Huang, Jianwei Pan, Hou-Zao Chen, Jinghai Chen, Andreas Linkermann, Junxia Min, and Fudi Wang. Loss of cardiac Ferritin H facilitates cardiomyopathy via Slc7a11-mediated ferroptosis. Circulation Research, 2020, Epub ahead of print.【2】Xuexian Fang, Hao Wang, Dan Han, Enjun Xie, Xiang Yang, Jiayu Wei, Shanshan Gu, Feng Gao, Nali Zhu, Xiangju Yin, Qi Cheng, Pan Zhang, Wei Dai, Jinghai Chen, Fuquan Yang, Huang-Tian Yang, Andreas Linkermann, Wei Gu, Junxia Min and Fudi Wang. Ferroptosis as a target for protection against cardiomyopathy. Proc Natl Acad Sci U S A. 2019;116(7):2672-2680.【3】Marcus Conras and Bettina Proneth. Broken hearts: Iron overload, ferroptosis and cardiomyopathy. Cell Res. 2019;29(4):263-264.【4】Tracy Hampton. New target to protect against cardiomyopathy. Circulation. 2019; 139:2278-2279.【5】Hao Wang, Peng An, Enjun Xie, Qian Wu, Xuexian Fang, Hong Gao, Zhuzhen Zhang, Yuzhu Li, Xudong Wang, Jiaying Zhang, Guoli Li, Lei Yang, Wei Liu, Junxia Min and Fudi Wang. Characterization of ferroptosis in murine models of hemochromatosis. Hepatology, 2017, 66(2):449-65.【6】方学贤, 蔡昭贤, 王浩, 闵军霞, 王福俤. 铁过载及铁死亡在心脏疾病中的研究进展. 科学通报. 2019, 64:2974-2987.专家点评一阎锡蕴:中国科学院院士,中科院生物物理研究所研究员神奇的铁蛋白(Ferritin)是一种由24个亚基构成的储铁蛋白,它具有水合氧化铁内核及笼形蛋白质外壳,外径12~13nm,空心直径约为8nm,铁核中可积累多达4000个铁原子。Ferritin亚基由重链(Fth)和轻链(Ftl)组成,由于Fth具备催化亚铁离子(Fe2+)转化为三价铁离子(Fe3+)的亚铁氧化酶活性,因此在生物体内表现出多种重要的生理功能。临床上,铁蛋白不仅被广泛应用于疾病诊断的标志物,如缺铁性贫血、铁过载、炎症反应及肿瘤标志物等,而且作为新型纳米酶能够特异性靶向肿瘤细胞,是一种十分理想的纳米药物载体。近期,欣喜地看到多年从事铁稳态代谢的王福俤教授团队又一次带给我们有关铁蛋白的最新里程碑式研究成果。该成果利用心肌细胞特异敲除小鼠,在体内首次揭示Fth对心脏的重要保护作用。王福俤团队研究发现:Fth敲除造成游离铁离子增多,进而通过铁死亡机制损伤心肌细胞并可发展为致死性心脏疾病。该成果清晰展示和解析了铁蛋白缺失导致心脏疾病发生发展的致病轨迹,为Fth这样一个“经典”基因完美诠释了其调控心脏铁死亡的首个体内新证据。据悉该发现是王福俤团队在铁死亡研究领域获得系列重大原创成果基础上的又一重磅硕果。总之,该重大科技成果主要有三个方面突出贡献:(1)首次体内揭示Fth在心脏生理病理中的重要功能;(2)揭秘 Fth和Slc7a11是防治铁死亡引发心脏疾病的新靶点,具有广阔临床转化前景;(3)在国际上建立首个“心脏铁死亡”以及“铁死亡逆转”小鼠模型,为进一步药物筛选及铁死亡机制研究提供先进的研究模型。专家点评二杨黄恬:中国科学院上海营养与健康研研究所 研究员 研究组组长J Mol Cell Cardiol 期刊副主编心脏疾病是严重威胁人类生命健康的头号杀手。引发心脏疾病的致病因素众多而且机制复杂,迄今,对于心肌病及心力衰竭(心衰)等致死性疾病尚缺乏有效根治的方法,因此心脏疾病的防治一直是全球医学及生命科学领域重点攻关的热点及难点。早在2019年初,王福俤教授率领的科研团队利用小鼠模型在全球首次报道铁死亡是引发缺血/再灌等多种心脏损伤的重要致病机制(PNAS,2019)。该里程碑式成果为靶向铁死亡治疗缺血性心脏病开创了历史先河,因而获得领域同行的高度关注和点评。令人欣喜的是新近王福俤教授率领的团队在这一研究领域取得了新突破——揭秘维持心肌细胞铁稳态平衡、保护心脏对抗铁死亡引发心肌病的新靶点及新机制。研究发现为心肌病的治疗提供了新思路和新靶点。2020年4月30日在Circ Res在线报道了王福俤教授率领的科研团队的最新研究发现(https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.120.316509)。作者通过采用小鼠遗传学技术成功构建了心衰特征明显的“心脏铁死亡”小鼠模型(铁蛋白重链心肌细胞特异敲除);通过全基因组转录测序技术筛查“心脏铁死亡”小鼠心肌细胞基因谱,研究人员首先发现了Slc7a11表达被显著抑制。通过巧妙的反向思维,他们构建心脏特异过表达Slc7a11小鼠模型并通过与转铁蛋白蛋白心肌细胞敲除小鼠杂交,结果发现过表达Slc7a11基因能够显著逆转“心脏铁死亡”导致的心肌损伤及预防扩张型心肌病(DCM)的发生。进一步通过氨基酸组学分析结合功能验证,作者首次揭示了Slc7a11通过增加心肌细胞内的胱氨酸促进谷胱甘肽(GSH)大量合成,结果清除脂质过氧化在心肌细胞中的堆积,从而成功逆转转铁蛋白缺失引发的铁死亡、心肌损伤及DCM的发生。DCM是引起心衰、心律失常和猝死的常见疾病之一,致死率高且缺乏有效治疗措施。该开创性发现为靶向心脏铁死亡防治心脏疾病的临床转化研究奠定了坚实的科学依据,并为破解多年来困扰国际DCM临床有效防治的难题提供了重要线索。专家点评三周斌:中国科学院分子细胞科学卓越创新中心研究员,国家杰青铁死亡(Ferroptosis)是铁离子依赖的新型程序性细胞死亡方式。早在2012年,铁死亡是基于体外(In Vitro)细胞模型中观察到的一种既非凋亡又非坏死而且能被铁螯合剂挽救的细胞死亡方式(Cell,2012),之后人们逐渐认识到铁死亡可能引发肾脏及肝脏等重要脏器损伤并参与神经退行性等疾病的发生发展。因此短短几年,铁死亡已经成为全球生命科学研究热点。浙江大学医学院王福俤/闵军霞团队在2017年利用基因敲除小鼠模型探索发现铁死亡是铁过载诱发肝脏损伤中的重要致病机制(Hepatology,2017,封面论文)。由于这一成果在小鼠体内(In Vivo)首次揭示胱氨酸转运蛋白Slc7a11通过调控铁死亡参与血色病小鼠肝损伤的发病机制而备受国际学术界重视。心肌细胞死亡是多种心脏疾病发生过程的共同病理基础,因而解读心肌死亡方式一直是生命医学领域重点关注的关键科学问题。2019年初,王福俤团队在国际上率先揭示铁死亡引发心肌细胞损伤的新机制(PNAS,2019),自此开辟了“心脏与铁死亡”研究先河。近期,国际知名学术期刊《Circulation Research》刊登了王福俤团队令人振奋的最新研究成果。通过系统性研究,作者首先锁定铁蛋白重链(Ferritin H,Fth)基因可能参与铁死亡。Fth是组成铁蛋白的两种亚基之一,通过其亚铁氧化酶活性催化亚铁离子(Fe2+)转化为三价铁离子(Fe3+),从而发挥限制二价铁和过氧化氢之间发生的有害芬顿反应(Fenton reaction)的重要生理功能。为了体内验证,作者团队利用Cre/LoxP技术制备了两种心肌细胞特异性Fth敲除小鼠模型,提供遗传学实验数据证明这些Fth缺失小鼠的心肌细胞的确发生了铁死亡。这是国际上第一个“心脏铁死亡”的遗传小鼠模型,为深入探索部分心脏疾病发生的病理机制及研发靶向铁死亡防治心脏疾病的药物提供可靠动物模型。此外,该铁死亡领域中里程碑式研究成果还为今后研究心脏铁死亡提供了另一新型小鼠模型,即膜蛋白Slc7a11的心脏组织特异表达的转基因小鼠。研究者们充分展示过表达Slc7a11小鼠显著逆转Fth缺失诱发的心肌损伤表型;完美解读了Slc7a11通过增加细胞内的胱氨酸转运及促进GSH合成而发挥抑制铁死亡发生的关键分子调控机制;明确了Slc7a11是心脏疾病防控的重要新靶点,为心脏疾病诊治提供了崭新思路。

近日,来自浙江大学公共卫生学院王福俤团队联合医学院/转化医学研究院闵军霞团队及广东省微生物研究所谢黎炜团队在国际著名学术期刊Advanced Science(影响因子15.804)发表题为“Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes”的研究论文[1]。揭示转铁蛋白受体(Transferrin Receptor 1, Tfr1)通过特异机制调控棕色/米色脂肪细胞功能和发育。在米色脂肪形成过程中,活化的缺氧诱导因子HIF1α通过转录调控Tfr1表达促进铁吸收从而维持线粒体功能;在棕色脂肪发育过程中,Tfr1以非铁依赖的方式调控棕色脂肪与白色脂肪、肌细胞的转分化。脂肪组织是参与调控全身能量代谢的重要器官,主要由三种脂肪细胞构成:白色、棕色和米色。白色脂肪用于贮存能量,而棕色脂肪用于消耗能量,通过非战栗性产热来维持体温恒定。活化棕色脂肪有助于机体抵抗能量摄入过多引起的脂肪堆积,从而抑制肥胖的发生[2]。米色脂肪是近年来新发现可以被冷刺激或β3-肾上腺素受体激动剂诱导形成的一种产热脂肪,在治疗肥胖及相关代谢性疾病方面有极好的应用前景[3]。通过深入了解白色脂肪米色样变及棕色脂肪形成和活化的分子调控机制,对于靶向干预促进棕色/米色脂肪产热具有重要的理论和实践意义。微量元素铁在维持营养和能量代谢平衡中扮演重要角色[4]。脂肪细胞铁稳态代谢的研究多集中在白色脂肪。在白色脂肪细胞分化过程中,通过DFO螯合细胞中铁离子或者敲降转铁蛋白(Tf)可以显著抑制脂合成[5];添加铁和Tf可以促进脂肪细胞脂解[6],抑制胰岛素刺激的葡萄糖吸收[7]。遗传性低铁模型Tmprss6敲除小鼠脂肪组织铁含量减少,白色脂肪脂解增加,从而抵抗高脂膳食诱导的肥胖[8]。然而铁稳态代谢对棕色脂肪细胞分化产热以及白色脂肪米色化的调控作用及其分子机制尚待深入研究。研究人员在β3肾上腺素激动剂CL-316,243诱导米色脂肪形成的小鼠模型上,通过H3K9/14Ac ChIP-seq、RNA-seq和iTRAQ膜蛋白质组等多种组学技术发现铁稳态代谢被明显富集,并筛选出转铁蛋白受体Tfr1表达显著上调。随后发现Tfr1脂肪特异性敲除(Tfr1Adp/Adp)小鼠对冷不耐受,冷诱导的米色脂肪细胞形成被抑制,冷诱导的棕色脂肪产热和脂解减少,线粒体形态和铁稳态代谢异常(图一)。在高脂膳食(HFD)诱导的肥胖模型下,Tfr1敲除虽然不影响食欲和体重,但是可加剧HFD诱导的脂代谢紊乱、胰岛素抵抗和脂肪组织炎症。图一:Tfr1脂肪特异性敲除小鼠棕色/米色脂肪功能异常(选自Li et al. Advanced Scicence, 2020)随后,研究人员对米色脂肪形成过程中Tfr1表达上调的分子机制进行了研究,发现缺氧诱导因子HIF1α蛋白表达和入核活化明显增加,棕色脂肪特异性敲除Hif1α(Hif1Ucp1/Ucp1)小鼠表现出冷诱导的米色脂肪生成被抑制,而棕色脂肪却未见明显改变。通过Chip-qPCR实验发现冷刺激可以诱导米色脂肪HIF1α与Tfr1启动子结合促进其转录。以上结果提示冷刺激诱导HIF1α活化,通过转录调控Tfr1表达控制铁吸收从而促进白色脂肪米色化。为了解析Tfr1敲除导致棕色脂肪功能异常的机制,研究人员通过转录组分析发现Tfr1敲除可以明显增加干细胞、白色脂肪细胞和肌细胞标志基因表达,并对这些基因表达进行验证。从而表明Tfr1在棕色脂肪细胞命运决定中扮演重要角色。然而这一作用与Tfr1敲除造成的低铁状态无关,因为无论是遗传性低铁(Tmprss6-/-)小鼠模型还是孕期低铁饲喂均不能模拟Tfr1敲除引起的棕色脂肪细胞向肌细胞转分化,表明Tfr1可能通过非铁依赖的作用调控棕色脂肪细胞分化。然而Tmprss6-/-小鼠冷诱导的米色脂肪生成被抑制,表明铁稳态在白色脂肪米色化过程中起重要作用。Tfr1如何通过铁依赖与非铁依赖作用调控棕色/米色脂肪细胞产热和分化仍待进一步研究。图二:Tfr1调控棕色/米色脂肪细胞产热和分化的模式图(选自Li et al. Advanced Scicence, 2020)该原创成果发现Tfr1和铁稳态代谢在调控棕色和米色脂肪细胞产热和命运决定中的关键作用,揭示了冷刺激诱导活化的HIF1α通过转录调控Tfr1促进白色脂肪米色化。该重大成果为脂肪细胞命运调控及机体铁稳态代谢提供新的认识,为肥胖及相关代谢性疾病靶向治疗提供了新思路。浙江大学医学院李瑾博士后为本文的第一作者;王福俤教授、闵军霞教授及谢黎炜研究员为共同通讯作者;浙江大学医学院为第一作者及通讯作者单位。该项目得到国家自然科学基金委及国家科技部项目资助。参考文献:1.Li J#, Pan X#, Pan G, Song Z, He Y, Zhang S, Ye X, Yang X, Xie E, Wang X, Mai X, Yin X, Tang B, Shu X, Chen P, Dai X, Tian Y, Yao L, Han M, Xue G, Zhong H, Sun J, Chen H, Wang F*, Min J*, Xie L*. Transferrin Receptor 1 Regulates Thermogenic Capacity and Cell Fate in Brown/Beige Adipocytes.Advanced Science 2020.全文链接:https://doi.org/10.1002/advs.2019033662.Lowell BB, V SS, Hamann A, Lawitts JA, Himms-Hagen J, Boyer BB, Kozak LP, Flier JS. Development of obesity in transgenic mice after genetic ablation of brown adipose tissue. Nature 1993, 366(6457): 740-742.3.Wu J, Bostrom P, Sparks LM, Ye L, Choi JH, Giang AH, Khandekar M, Virtanen KA, Nuutila P, Schaart G, Huang K, Tu H, van Marken Lichtenbelt WD, Hoeks J, Enerback S, Schrauwen P, Spiegelman BM. Beige adipocytes are a distinct type of thermogenic fat cell in mouse and human. Cell 2012, 150(2): 366-376.4. 王佳明, 安鹏, 王浩, 吴谦, 方学贤, 闵军霞, 王福俤. 铁稳态代谢分子机制及铁磁纳米颗粒研究进展. 科学通报, 2018, 63, Doi:10.1360/N972018-007075.Moreno-Navarrete JM, Ortega F, Moreno M, Ricart W, Fernandez-Real JM. Fine-tuned iron availability is essential to achieve optimal adipocyte differentiation and mitochondrial biogenesis. Diabetologia 2014, 57(9): 1957-1967.6.Rumberger JM, Peters T, Jr., Burrington C, Green A. Transferrin and iron contribute to the lipolytic effect of serum in isolated adipocytes. Diabetes 2004, 53(10): 2535-2541.7.Green A, Basile R, Rumberger JM. Transferrin and iron induce insulin resistance of glucose transport in adipocytes. Metabolism: clinical and experimental 2006, 55(8): 1042-1045.8.Folgueras AR, Freitas-Rodriguez S, Ramsay AJ, Garabaya C, Rodriguez F, Velasco G, Lopez-Otin C. Matriptase-2 deficiency protects from obesity by modulating iron homeostasis. Nature communications 2018, 9(1): 1350.

浙江大学公共卫生学院王福俤教授团队,通过新冠肺炎临床研究荟萃分析发现:高血压、心血管疾病、慢性肾病及糖尿病等慢性疾病显著增加新冠肺炎(COVID-19)重症发生风险;急性心脏及肾脏损伤与死亡风险高度相关。该研究为科学筛查新冠肺炎重症及死亡高危人群、优化诊疗方案及有效降低死亡率等提供了可靠的循证医学证据。该研究于4月19日发表在《Research》(Research,2020,DOI: 10.34133/2020/2402961)杂志上。该研究是迄今全球最大的新冠肺炎重症及死亡风险荟萃分析;共纳入34项临床研究数据,6263例患者,包括1727名重症和4536名非重症。论文链接:https://spj.sciencemag.org/research/2020/2402961/新冠病毒(SARS-CoV-2)已成为全球“大流行”。由于目前缺乏有效疫苗或抗病毒药物,而且新冠感染患者在不同国家或地区间的病死率差异很大。探索引发重症及死亡的风险因素、优化治疗策略及降低死亡率是当务之急。研究者通过系统性分析新冠患者的临床大数据,针对重症及死亡风险开展了荟萃分析。在王福俤教授和闵军霞教授指导下,王鑫慧博士和方学贤博士等对来自全国多个地区的34项回顾性临床研究,包括6,263例新冠肺炎患者(1,727名重症患者和4,536名非重症患者)的临床数据及其共患疾病状态进行了提取和分析。发现高血压、心血管疾病、慢性肾脏疾病及糖尿病增加COVID-19患者的重症发生风险;然而,慢性肝脏疾病与COVID-19重症发生率之间未发现相关性。这些结果提示,既往高血压、心血管疾病、慢性肾脏疾病及糖尿病患者是发生重症的高风险人群,需要尽早采取相关防控措施。进一步深入分析发现:急性心脏或肾脏损伤与COVID-19死亡率增加高度相关。提示心肾损伤是引发死亡的重要因素。通过计算发现,高血压和心血管疾病病史分别可增加2.89倍(95% CI: 2.32, 3.60)及3.84倍(95% CI: 2.90, 5.07)新冠肺炎重症发生的风险。慢性肾脏疾病病史可提升2.22倍新冠肺炎重症发生风险(95% CI: 1.14, 4.31)。糖尿病病史增加2.65倍新冠肺炎重症发生的风险(95% CI: 2.08, 3.37)。然而,慢性肝脏疾病病史并未增加新冠肺炎重症发生的风险(OR: 0.86, 95% CI: 0.42, 1.75)。新冠肺炎患者大部分临床表现症状较轻,但约有20%的感染患者可发展为重症,甚至严重威胁生命。由于全球大流行,新冠肺炎的集中爆发对于医疗体系形成极大压力。该研究成果提示高血压、心血管疾病、慢性肾脏疾病和糖尿病等常见慢性疾病可能是导致新冠重症的重要诱因,因此,为合理分配医疗资源提供重要依据。此外,该研究发现新冠肺炎患者的心脏或肾脏的急性损伤可能是促发死亡的重要危险因素。为此,临床上对于既往慢病病史的新冠感染患者以及重症患者,需要密切监护心脏及肾脏功能,避免心肾损伤可有效降低致死率。关于这些研究发现的病理生理机制,尽管目前尚不明确,但以下几个因素可能相关。首先,SARS-CoV-2病毒通过人体组织器官中的ACE2受体蛋白进入细胞,攻击受体表达的组织器官,如心脏、肾脏及胰腺。第二,常见既往慢病,包括高血压、心血管疾病、慢性肾脏疾病和糖尿病,可能存在免疫应答失调,进而导致这些组织器官更易受到病毒感染。第三,某些临床上使用的抗病毒药物,如氯喹、利巴韦林和洛匹那韦/利托那韦等引发器官损伤在内的毒副作用。第四,新冠患者的急性呼吸窘迫综合征(ARDS)引起的缺氧可促进多组织器官的损伤。最后,其他病原体的继发感染也可能促发急性器官损伤。综上所述,本研究通过大数据明确既往高血压、心血管疾病、慢性肾脏疾病和糖尿病及心肾损伤是增加COVID-19重症发生及死亡率增加的重要危险因素,为指导临床早期科学分诊和监护,预防新冠感染患者重症发生并有效降低死亡率提供了重要循证医学依据。王福俤教授和闵军霞教授(浙江大学转化医学研究院)为共同通讯作者;王鑫慧副教授、方学贤博士后及博士研究生蔡昭贤、吴晓甜和高笑童为共同第一作者。该项目得到国家科技部重点研发计划资助。通讯作者简介 王福俤,营养学/预防医学博士,博士生导师,浙江大学医学院求是特聘教授,浙江大学营养与食品安全研究所所长。国家万人计划学者、国家杰青、科技部中青年领军人才、国家百千万人才“有突出贡献中青年”、中科院百人计划学者、国务院政府津贴、中国生物物理学会生物微量元素分会理事长、科学中国人年度人物奖(2011)、健康宣教微信公众号“营养发现”创始人。曾在美国哈佛大学等高校任讲师及研究副教授。长期致力于营养代谢与重大疾病防控的分子机制、转化医学及人群流行病学研究,并取得系列突出成绩;在Nature Genetics、Nature、Blood、Hepatology及PNAS等国际著名学术期刊发表120余篇研究论文;论文他引4100余次。先后主持国家自然科学基金重点项目(4项)及科技部重点研发计划项目(首席科学家)。论文出处:Xinhui Wang , Xuexian Fang , Zhaoxian Cai, Xiaotian Wu , Xiaotong Gao , Junxia Min , and Fudi Wang. Comorbid Chronic Diseases and Acute Organ Injuries Are Strongly Correlated with Disease Severity and Mortality among COVID-19 Patients: A Systemic Review and Meta-Analysis. Research, 2020, Article ID 2402961, https://doi.org/10.34133/2020/2402961 《Research》是中国科协与美国科学促进会于2018年共同创办的定位为国际化、高影响力、世界一流水平、综合性、大型OA科技期刊,是美国《Science》自1880年创刊以来第一本合作期刊。主要发表生命科学、新材料研、新能源、人工智能、微纳米科学、环境科学、机械科学、机器人与先进制造8个具有巨大发展潜力的热点交叉领域突破性研究成果。目前已建立了93人的国内外各占50%、具有国际影响力的编委会,主编(中国)为西北工业大学常务副校长、中科院院士黄维,主编(国际)为美国明尼苏达大学麦克凯特杰出教授崔天宏。已被CAS、CSCD、DOAJ、ESCI、INSPEC、PMC、Scopus数据库收录。
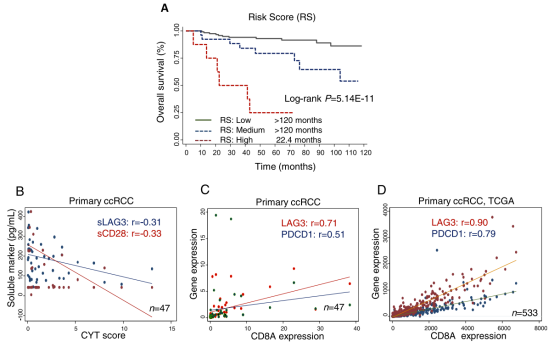
吴息凤教授在《Journal for ImmunoTherapy of Cancer》上发表题为“Soluble immune checkpoint-related proteins as predictors of tumor recurrence, survival, and T cell phenotypes in clear cell renal cell carcinoma patients”的研究。该研究发表于2019年12月,揭示了肾透明细胞癌复发、生存和T细胞表型相关的预测因子。免疫检查点抑制剂在癌症免疫治疗中取得了前所未有的成功。除了少数候选生物标记物外,可溶性免疫检查点相关蛋白在透明细胞肾细胞癌(ccRCC)患者中的预后作用基本上尚未研究。本研究采用多重Luminex分析法分析了182例ccRCC患者14种免疫检查点相关蛋白(BTLA、GITR、HVEM、IDO、LAG-3、PD-1、PD-L1、PD-L2、Tim-3、CD28、CD80、CD137、CD27和CTLA-4)的循环水平及其与复发和死亡风险的关系。研究人员分析了部分患者研究人群(n=47)和来自TCGA的533例原发性ccRCC的肿瘤组织基因表达,以阐明潜在的机制。我们的主要终点是总体生存;次要终点是无复发生存率。本研究采用多变量Cox比例风险模型、非条件logistic回归模型和Kaplan-Meier分析。结果显示,sTIM3和sLAG3与进展期(III期)疾病显著相关(P<0.05)。sPD-L2是复发的最强预测因子(HR 2.51,95%CI 1.46-4.34,P=9.33E-04),而高sBTLA和sTIM3与生存率降低相关(HR 6.02,95%CI 2.0-18.1,P=1.39E-03和HR 3.12,95%CI 1.44-6.75,P=3.94E-03)。基于sTIM3和sBTLA的风险评分表明,联合两个可溶性免疫检查点相关蛋白可预测ccRCC的复发和死亡风险(P=0.01和4.44E-04)。此外,sLAG3和sCD28与肿瘤中T细胞的细胞溶解活性呈负相关(rho分别为-0.31和-0.33)。本研究证明可溶性免疫检查点相关蛋白可能与ccRCC患者的进展性疾病、复发和生存相关,提示了可溶性免疫检查点相关蛋白的预后价值。 图1. ccRCC患者可溶性免疫检查点蛋白水平的无复发生存期(RFS)和总生存期(OS)的Kaplan Meier分析图2. 可溶性免疫检查点的风险评分作为ccRCC生存的预测因子及其与原发肿瘤T细胞功能的相关性
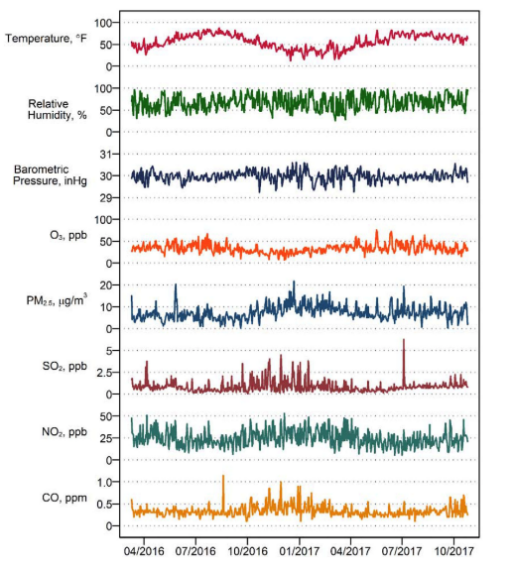
2019年11月,我院李文渊研究员在Environment International杂志发表题为“Weather, ambient air pollution, and risk of migraine headache onset among patients with migraine”的研究论文。该论文探索了温度、相对湿度、大气压力和环境空气污染物与偏头痛发作的关系。该研究共收集了超过4400天的睡眠数据,是当时客观测量睡眠且随访时间最长的关于睡眠与偏头痛的研究项目。偏头痛作为一种常见的原发性头痛,影响因素复杂。以往的研究发现睡眠不足、压力、饮酒、咖啡因、异常天气和空气污染等都可能是偏头痛发病的危险因素。然而,大部分该类研究依赖于调查问卷数据而缺乏客观记录。一些流行病学研究通过每日头痛调查问卷客观测量了天气数据,并前瞻性收集了偏头痛事件。然而早期研究受到分析方法的限制,过去二十年的研究认为部分偏头痛患者更易受天气影响,空气污染水平可能会受到区域气候的影响,结果仍有待进一步验证。该队列研究纳入了98名间歇性或偶发性偏头痛患者,并随访至少6周。每位患者每天回答两次网络电子调查问卷,并佩戴腕式活动记录仪客观记录其睡眠时间与睡眠质量。本研究共收集了超过4400天的睡眠数据,通过采用个体重复测量的方法分析了每日天气条件及空气污染水平对偏头痛发作的影响,结果表明天气因素及空气污染对偏头痛发作的影响呈现一定的季节性,夏秋季(4月至9月)高度潮湿的环境以及冬春季(10月至3月)较高的交通相关空气污染物水平都与偏头痛发作相关。